Diagnosi genetica preimpianto (PGT-A, PGT-SR, PGT-M)
Diagnosi genetica preimpianto (PGT-A/PGS, PGT-SR, PGT-M)
La denominazione diagnosi genetica preimpianto raccoglie un gruppo di tecniche basate sull’analisi di alcune cellule della blastocisti per valutare l’assetto cromosomico dell’embrione, al fine di aumentare le probabilità di gravidanza per transfer e ridurre le probabilità di aborto (PGT-A o PGT-SR) o per rilevare la presenza di mutazioni genetiche causa di gravi malattie ereditarie (PGT-M).
Diagnosi genetica preimpianto per aneuploidie (PGT-A o PGS)
La PGT-A viene utilizzata per escludere dal trasferimento embrioni incapaci di impiantarsi o di svilupparsia causa di un corredo cromosomico anomalo. Questi embrioni costituiscono in media il 35% degli embrioni generati da una donna di 35 anni e aumentano progressivamente con l’età materna fino ad arrivare a circa l’85% in una donna di 44 anni (Fig. 1).
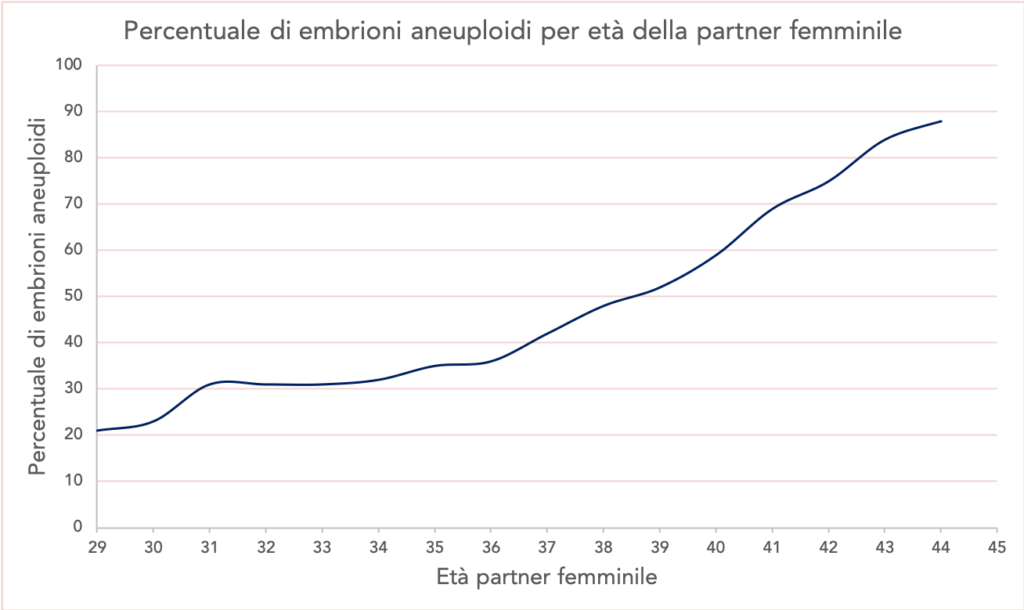
Fig.1 Probabilità che un embrione sia aneuploide (cromosomicamente anomalo) in base all’età materna
Con l’avanzare dell’età materna, la PGT-A rappresenta dunque una risorsa sempre più importante per aumentare le chance di impianto per transfer e ridurre il rischio di aborto spontaneo.
Le basi biologiche della diagnosi genetica preimpianto per aneuploidie (PGT-A)
La PGT-A o PGS si basa sul principio che una certa percentuale degli embrioni ai primi stadi dello sviluppo porta con sé un numero anomalo di cromosomi; questo tipo di corredo cromosomico viene definito aneuploide.
Come abbiamo visto, la percentuale di embrioni affetti da aneuploidie dipende principalmente dall’età della partner femminile. Questo è determinato dal fatto che, con l’aumentare dell’età della donna, aumenta anche la probabilità che i gameti femminili, gli ovociti, presentino un corredo cromosomico anomalo.
Considerato che il patrimonio genetico degli embrioni non è altro che la somma dei cromosomi contenuti nei gameti che li originano, se l’ovocita o lo spermatozoo che originano l’embrione possiedono delle anomalie, anche l’embrione conterrà queste anomalie. Per ragioni biologiche e a meno di particolari quadri patologici, gli spermatozoi tendono a essere meno soggetti ad aneuploidie e, conseguentemente, l’origine delle aneuploidie nell’embrione è prevalentemente materna.
Conseguenze dell’aneuploidia
Il più delle volte l’aneuploidia porta a un mancato impianto/sviluppo dell’embrione dopo il transfer, ma alcune volte può risultare in aborti spontanei o, più raramente, in nati con anomalie cromosomiche. Questo dipende principalmente da quanti e quali cromosomi sono coinvolti. Alcune aneuploidie sono infatti vitali, come la monosomia del cromosoma X che è associata alla sindrome di Turner, mentre altre non sono compatibili con la vita.
Come viene eseguita la diagnosi preimpianto
1. Biopsia del trofoectoderma dell’embrione allo stadio di blastocisti
La PGT-A o PGS viene eseguita prelevando 5-8 cellule dall’embrione allo stadio di blastocisti. In questa fase l’embrione è formato da due popolazioni di cellule distinte: il trofoectoderma (o trofoblasto) e la massa cellulare interna. Mentre quest’ultima è costituita da un insieme di cellule poste internamente all’embrione che andranno a formare il feto, il trofoblasto è formato dalle cellule che di differenzieranno negli annessi embrionali (es. la placenta), e si trovano aderenti all’interno della zona pellucida. Sono proprio le cellule del trofoblasto ad essere prelevate per l’analisi. Considerato che queste cellule in futuro andranno a formare i villi coriali, si può pensare alla biopsia del trofoectoderma come una sorta di villocentesi precoce.
Per poter prelevare le cellule del trofectoderma, si effettua una biopsia utilizzando un laser ad altissima precisione e un micromanipolatore. La procedura consiste nel forare con il laser la zona pellucida che circonda l’embrione e con una micropipetta si aspirano delle cellule dal trofoblasto della blastocisti. Queste vengono poi separate dal resto dell’embrione con il laser e poste in una provetta apposita per la successiva analisi (Fig. 2). L’embrione viene quindi vitrificato.
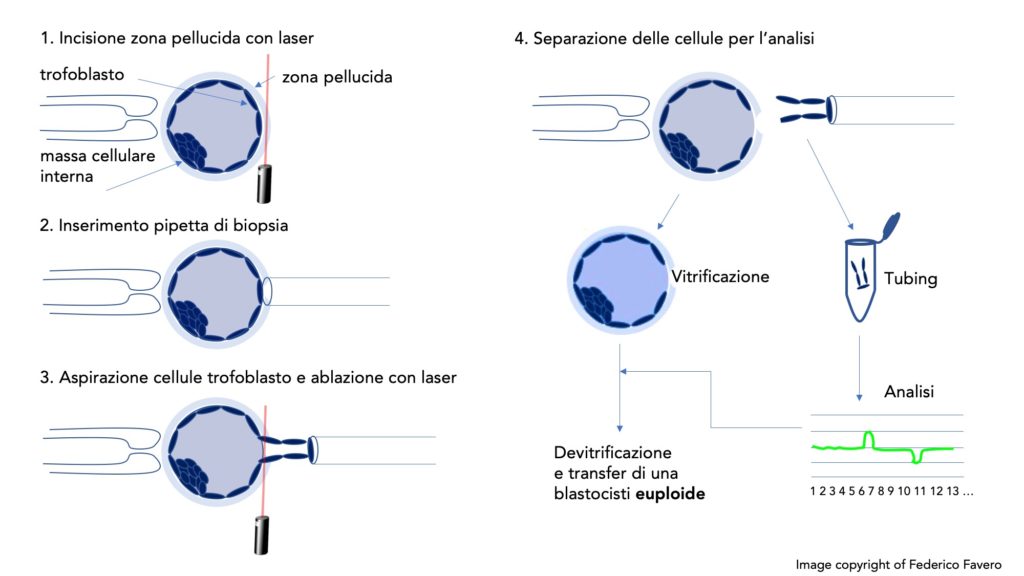
Fig. 2. Biopsia dell’embrione allo stadio di blastocisti e successiva analisi
2. Analisi e risultati
Le cellule sono analizzate mediante Next Generation Sequencing (NGS) per valutare l’assetto cromosomico degli embrioni. Si tratta di una procedura complessa in grado di analizzare con accuratezza i cromosomi degli embrioni anche a partire da un campione ridotto come 5-8 cellule. I risultati dell’analisi vengono forniti in circa 2 settimane.
I risultati definiscono lo stato di ploidia degli embrioni: per ogni embrione viene espresso il corredo cromosomico come euploide o aneuploide e in quest’ultimo caso viene specificato il tipo di anomalia specificando i cromosomi coinvolti.
I risultati vengono quindi illustrati alla coppia e discussi per delineare il percorso clinico successivo.
Rimuovere delle cellule dall’embrione ne riduce le capacità di sviluppo?
Nelle prime forme di biopsia embrionaria, venivano prelevate una o due cellule dell’embrione allo stadio di clivaggio, ovvero dopo 3 giorni dall’inseminazione. A questo stadio un embrione dallo sviluppo definito regolare è formato da 8 cellule. Diversi studi hanno evidenziato che la biopsia in terza giornata può essere dannosa all’embrione e dunque ad oggi questa forma di biopsia è limitata a poche realtà cliniche.
Più recentemente, è stata introdotta la biopsia embrionaria in quinta giornata, allo stadio di blastocisti, quando l’embrione è formato da 100-300 cellule organizzate già in due popolazioni cellulari (massa cellulare interna e trofoblasto; si veda sopra). Diversi studi hanno concluso che la rimozione di 5-8 cellule del trofoblasto a questo stadio è una procedura sicura, che non ha impatto sul potenziale di sviluppo dell’embrione. Di conseguenza, questo è il tipo di biopsia embrionaria che pratichiamo in ARC-STER.
I limiti della PGT-A/ PGS
La PGT-A non aumenta le probabilità di gravidanza per prelievo ovocitario, ma per tranfer eseguito.
Facciamo un esempio: una coppia ottiene 12 ovociti da un prelievo ovocitario, 6 dei quali si fecondano regolarmente e arrivano allo stadio di blastocisti. A questo punto la coppia può decidere di trasferirli (uno alla volta) senza conoscere il corredo cromosomico degli embrioni, oppure può decidere di eseguire PGT-A. Ipotizziamo che dalla PGT-A emerga che 3 embrioni sono euploidi e 3 aneuploidi. Senza conoscere il corredo cromosomico degli embrioni, la coppia ha il 50% di probabilità di trasferire un embrione aneuploide, che può risultare in un mancato impianto o in un impianto seguito da aborto spontaneo. Conoscendo il corredo cromosomico degli embrioni (PGT-A) la coppia può invece escludere dal transfer gli embrioni incompatibili con l’impianto. Questo costituisce certamente un vantaggio in termini di risparmio di tempoe diminuzione del rischio per transfer per questa coppia, ma il numero di embrioni euploidi rimane lo stesso anche se la coppia decidesse di non eseguire PGT-A. In altre parole, la PGT-A non consente di migliorare gli embrioni (come qualsiasi tecnica di PMA ad oggi) ma solo di deselezionare gli embrioni privi di potenziale di sviluppo.
I vantaggi della PGT-A/PGS
Gli embrioni definiti euploidi (ovvero con un corretto numero di cromosomi) hanno una maggior probabilità sia di impianto, che di risultare in una gravidanza a termine. Il principale vantaggio di trasferire un embrione euploide è dato dal fatto che la probabilità di gravidanza per transfer eseguito diventa indipendente dall’età materna ed è compresa tra il 50 e il 60% (senza PGT dipende dall’età, qui i dettagli). Allo stesso modo, trasferire un embrione euploide consente di abbassare le probabilità di aborto spontaneo dipendente dall’età (Fig. 3), a circa il 10%.
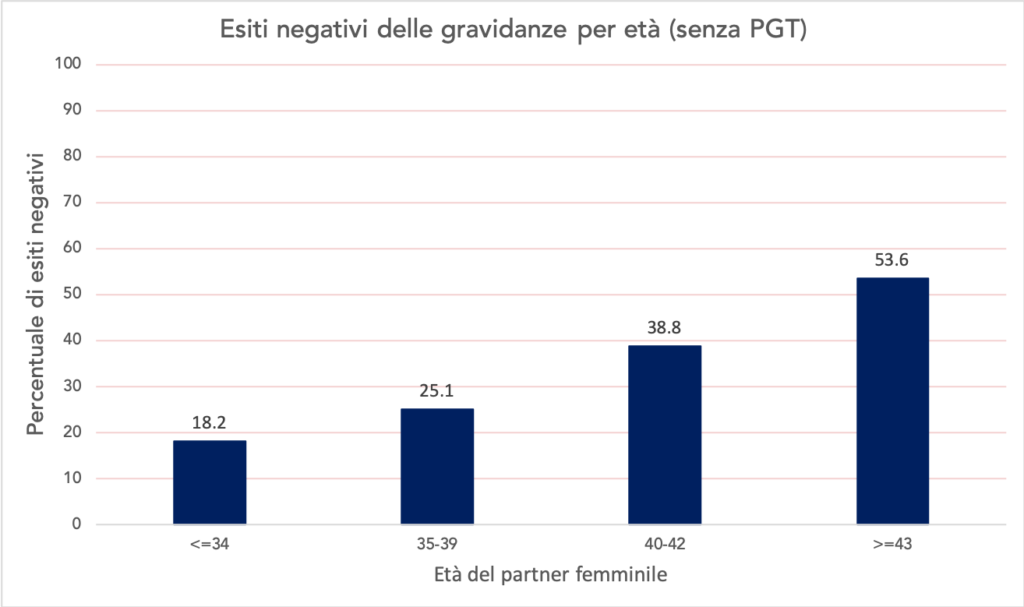
Fig.3 Esiti negativi delle gravidanze intraprese dopo trattamenti omologhi di PMA. Fonte: Istituto Superiore di Sanità, attività anno 2016 centri di PMA, link qui
È possibile che tutti gli embrioni siano aneuploidi?
È possibile, soprattutto in casi di età materna avanzata. Un mancato transfer perché non ci sono embrioni euploidi può essere difficile da accettare inizialmente, ma è importante ricordare che l’alternativa (ovvero la mancata conoscenza del corredo cromosomico degli embrioni) avrebbe portato a uno o più transfer con esito negativo, aumento dello stress e allungamento dei tempi necessari all’ottenimento della gravidanza.
Per chi è indicata la PGT-A/PGS
Per i vantaggi visti sopra, tutti i pazienti possono considerare la PGT-A per aumentare le chance di gravidanza a termine per transfer eseguito. La Società Italiana di Genetica Umana (SIGU) in particolare evidenzia alcuni gruppi di pazienti che possono beneficiare di questa tecnica:
- Età materna avanzata: ovvero se la partner femminile ha una età maggiore di 35 anni, considerata la correlazione tra aumento dell’età materna e incidenza delle aneuploidie
- Ripetuti fallimenti di impianto: definito quando siano stati effettuati >3 cicli con transfer di embrioni di buona qualità (o trasferiti in totale >10 embrioni) senza gravidanza clinica
- Ripetuti aborti spontanei(>3) nel primo trimestre. In casi selezionati dal clinico in base a diversi fattori come età e riserva ovarica
- Fattore maschile grave che richiede prelievo di spermatozoi per via chirurgica. La società, tuttavia, raccomanda cautela vista la scarsa evidenza clinica a supporto di questa indicazione.
In ARC-STER, ogni ginecologo decide insieme alla coppia quando effettuare un trattamento con PGT dopo aver valutato attentamente le indagini effettuate, eventuali trattamenti precedenti e diversi altri fattori.